Gelöster Sauerstoff (DO) ist ein Schlüsselelement in vielen wasserbezogenen Systemen: Kläranlagen, biologische Prozesse, Aquakultur usw.... Die maximale Sauerstoffkonzentration, die das Wasser enthalten kann, der so genannte Sättigungsgrad, hängt von einer Reihe physikalisch-chemischer Faktoren ab. Das Verständnis des Einflusses dieser Parameter ist für die Planung, Optimierung oder Kontrolle von Systemen, bei denen die Sauerstoffzufuhr eine entscheidende Rolle spielt, von wesentlicher Bedeutung.
Temperatur
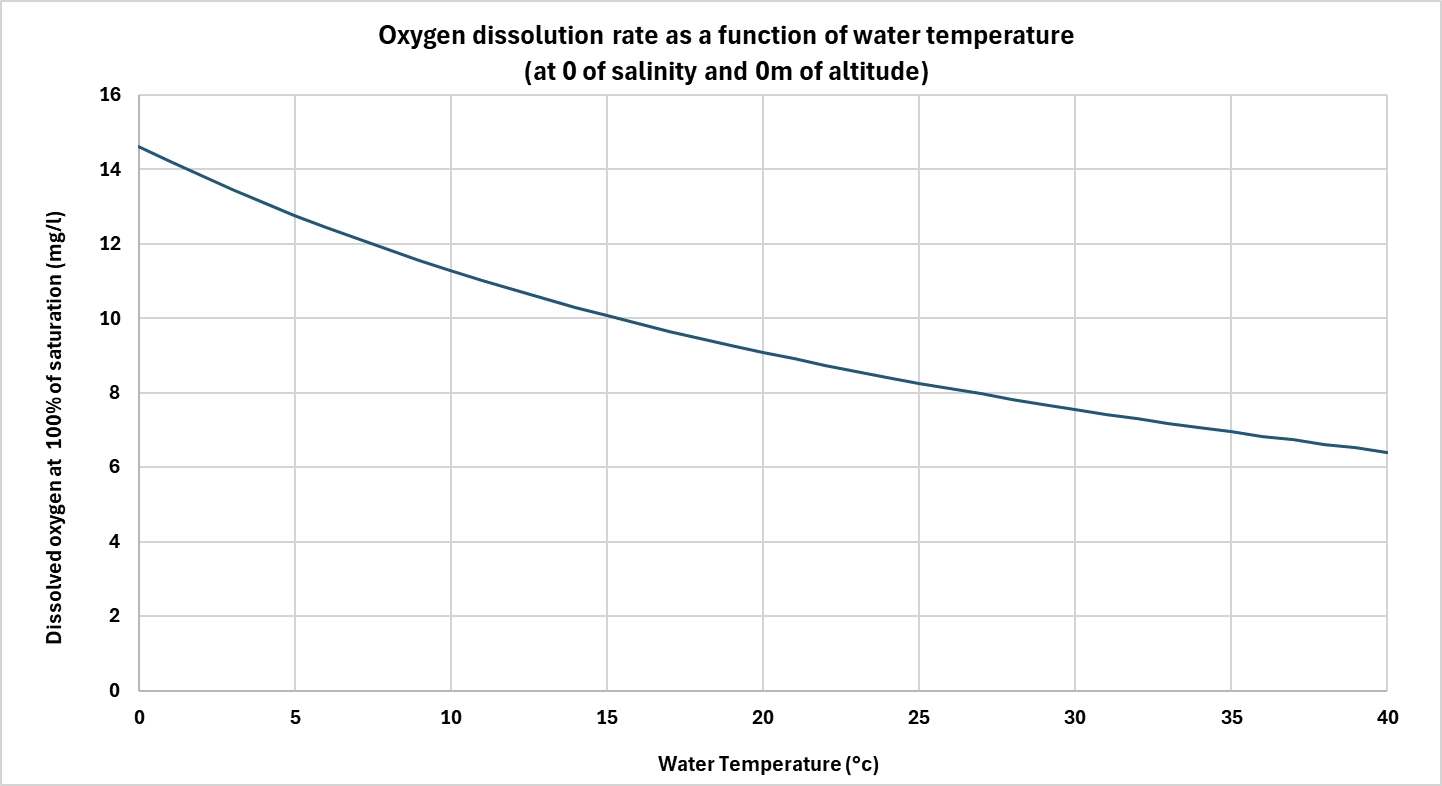
Die Wassertemperatur ist einer der wichtigsten Parameter, die die Sauerstofflöslichkeit beeinflussen. Je wärmer das Wasser ist, desto weniger Sauerstoff kann es lösen.
Dieses Phänomen erklärt sich durch die thermische Bewegung der Moleküle: Mit steigender Temperatur verringern sich die Wechselwirkungen zwischen Wassermolekülen und Sauerstoffmolekülen, was deren Abgabe an die Atmosphäre erleichtert. Bei normalem Atmosphärendruck kann Süßwasser beispielsweise bei 0 °C etwa 14,6 mg/L Sauerstoff enthalten, bei 30 °C dagegen nur noch 7,6 mg/L.
Bei biologischen Prozessen kann diese Abnahme der Löslichkeit ein Problem darstellen, da der Sauerstoffbedarf oft mit der Temperatur steigt (z. B. bakterielle Aktivität in Kläranlagen oder RAS), während die Sauerstoffverfügbarkeit abnimmt. Dieser Rückgang muss dann durch eine verbesserte Diffusion oder durch die Zufuhr von reinem Sauerstoff kompensiert werden.
Salinität
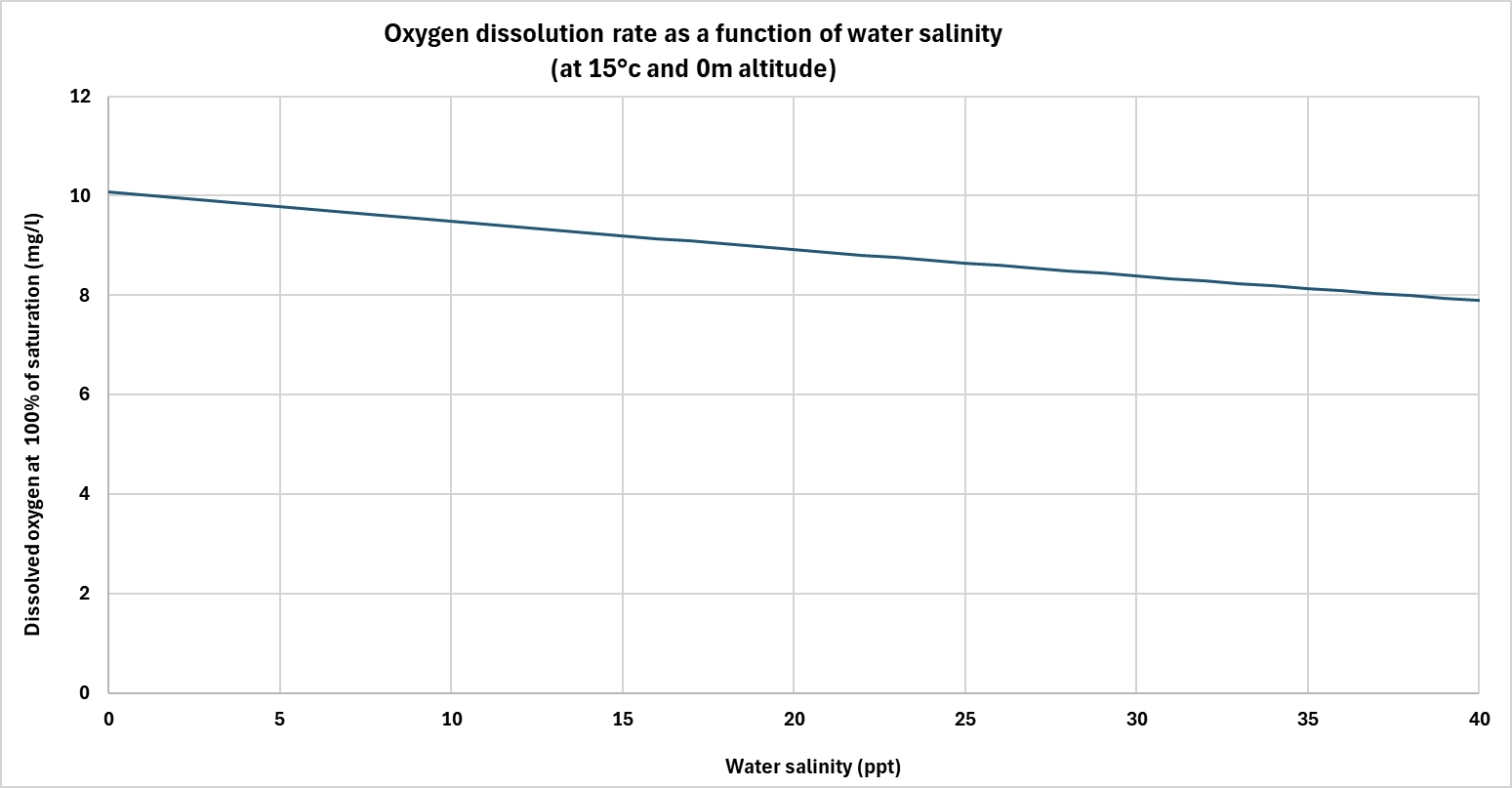
Auch der Salzgehalt spielt eine wichtige Rolle. Je salziger das Wasser ist, desto weniger gelösten Sauerstoff kann es aufnehmen.
Gelöste Salze treten an die Stelle von Gasmolekülen und verringern die Gesamtkapazität des Wassers, Sauerstoff zu speichern. Bei konstanter Temperatur und konstantem Druck enthält Meerwasser also von Natur aus weniger gelösten Sauerstoff als Süßwasser.
Gelöste Salze treten an die Stelle von Gasmolekülen und verringern die Gesamtkapazität des Wassers, Sauerstoff zu speichern. Bei konstanter Temperatur und konstantem Druck enthält Meerwasser also von Natur aus weniger gelösten Sauerstoff als Süßwasser.
Druck und Höhe
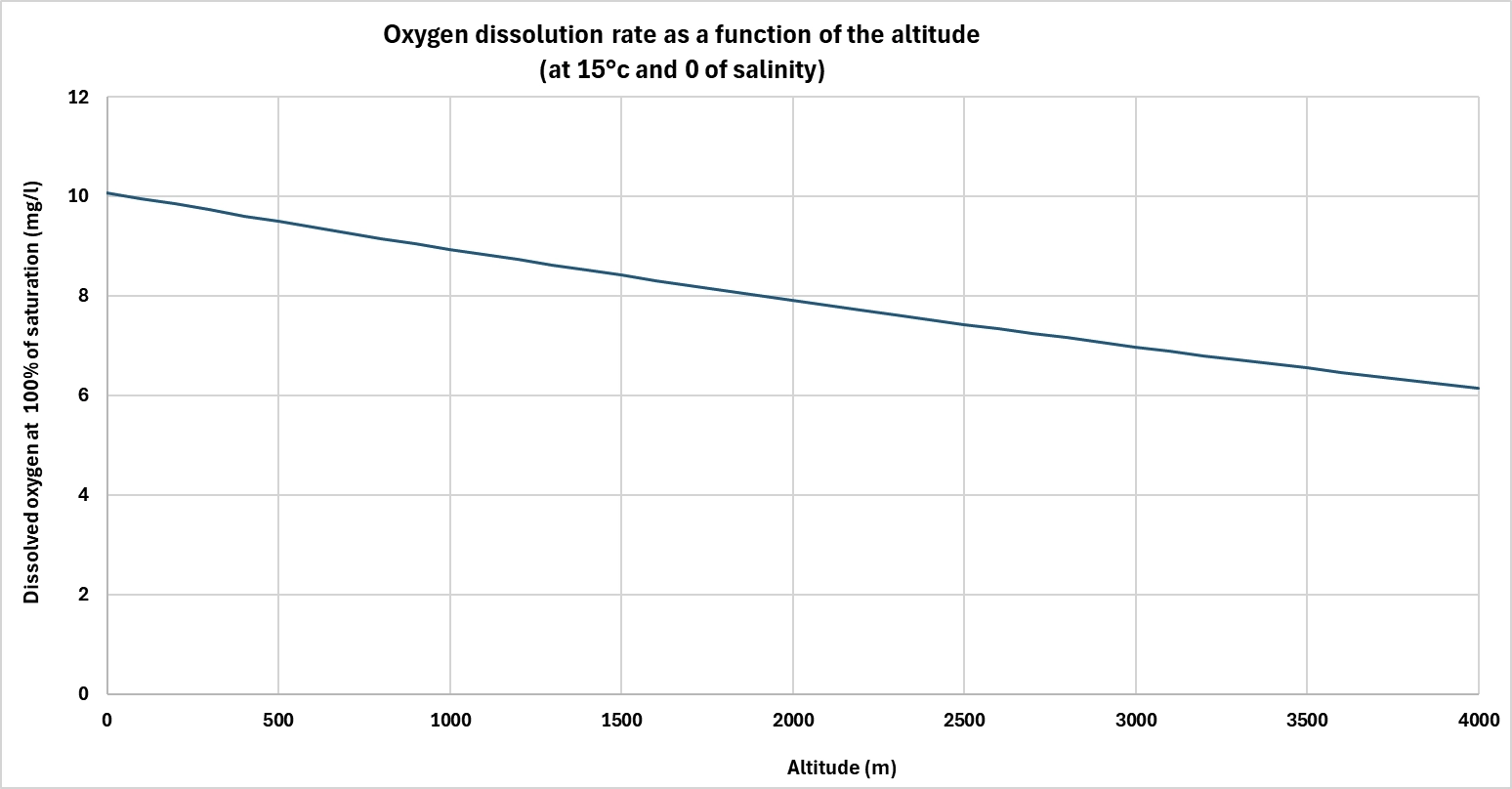
Der Atmosphärendruck wirkt sich direkt auf die Löslichkeit von Gasen in Wasser aus, einschließlich Sauerstoff. Je höher der Druck, desto mehr Sauerstoff kann das Wasser lösen.
In der Höhe sinkt der atmosphärische Druck, wodurch sich die Fähigkeit zur Sauerstoffsättigung verringert. Umgekehrt steigt in einer Umgebung mit hohem Druck die Löslichkeit. Dieses Prinzip wird in einer Reihe von Wasseraufbereitungstechnologien ausgenutzt, insbesondere um mit Sauerstoff übersättigtes Wasser zu erhalten.
So arbeiten beispielsweise Sauerstoffkonen im Allgemeinen mit einem Druck von mehreren Bar. Durch diesen Überdruck lassen sich wesentlich höhere Konzentrationen erreichen als bei atmosphärischem Druck. Sobald der Druck abgelassen wird, bleibt das Wasser vorübergehend in einem Zustand der Übersättigung, was die Wirksamkeit der Behandlungen verbessern kann (Oxidation in der Aquakultur, Verhinderung von H₂S biologischer Filter,....).
Schlussfolgerung
Die Sättigung mit gelöstem Sauerstoff wird durch bekannte physikalische Faktoren bestimmt: Temperatur, Salzgehalt und Druck. Ihr Einfluss ist in allen wasserbezogenen Bereichen, wie Aquakultur und Abwasserbehandlung, entscheidend.
Ob es darum geht, den ordnungsgemäßen Betrieb einer Kläranlage zu gewährleisten, die Ausbeute eines Oxidationsprozesses zu maximieren, die Geruchsbelästigung in Abwassernetzen zu begrenzen oder ein ökologisches Gleichgewicht zu erhalten, die Kontrolle dieser Parameter ist ein wesentlicher Hebel für eine effiziente und angemessene Sauerstoffanreicherung.

