L'ossigeno disciolto (DO) è un elemento chiave in molti sistemi legati all'acqua: impianti di trattamento delle acque reflue, processi biologici, acquacoltura, ecc.... La concentrazione massima di ossigeno che l'acqua può contenere, nota come livello di saturazione, dipende da una serie di fattori fisico-chimici. La comprensione dell'influenza di questi parametri è essenziale per la progettazione, l'ottimizzazione o il controllo di sistemi in cui l'ossigenazione svolge un ruolo cruciale.
La temperatura
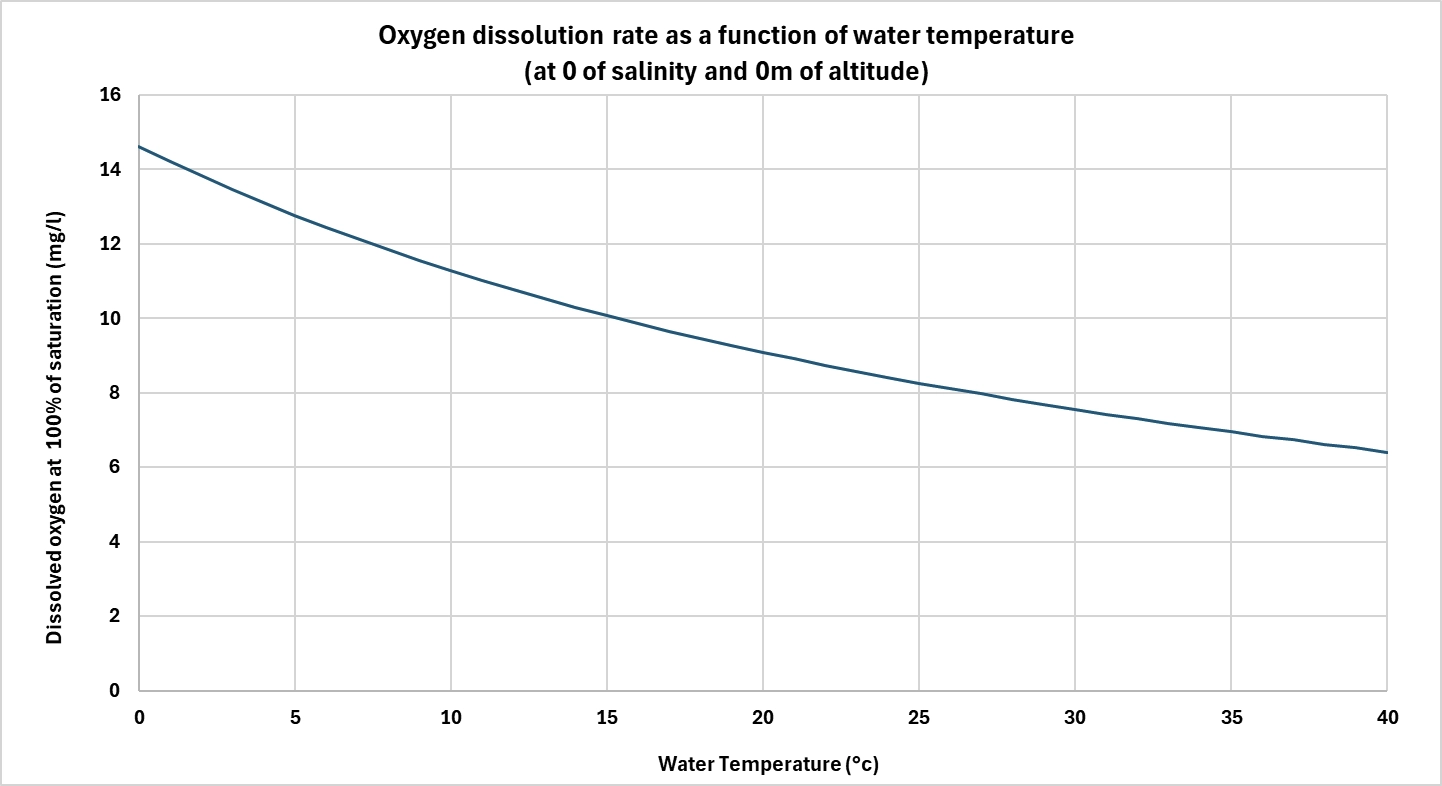
La temperatura dell'acqua è uno dei parametri più importanti che influenzano la solubilità dell'ossigeno. Più l'acqua è calda, meno ossigeno può sciogliere.
Questo fenomeno si spiega con l'agitazione termica delle molecole: l'aumento della temperatura riduce le interazioni tra le molecole d'acqua e quelle di ossigeno, facilitandone il rilascio nell'atmosfera. Ad esempio, a pressione atmosferica normale, l'acqua dolce può contenere circa 14,6 mg/L di ossigeno a 0°C, contro i soli 7,6 mg/L a 30°C.
Nei processi biologici, questa diminuzione della solubilità può rappresentare un problema, in quanto il fabbisogno di ossigeno spesso aumenta con la temperatura (ad esempio, l'attività batterica negli impianti di trattamento delle acque reflue o nei RAS), mentre la disponibilità di ossigeno diminuisce. Diventa quindi necessario compensare questo calo migliorando la diffusione o fornendo ossigeno puro.
Salinità
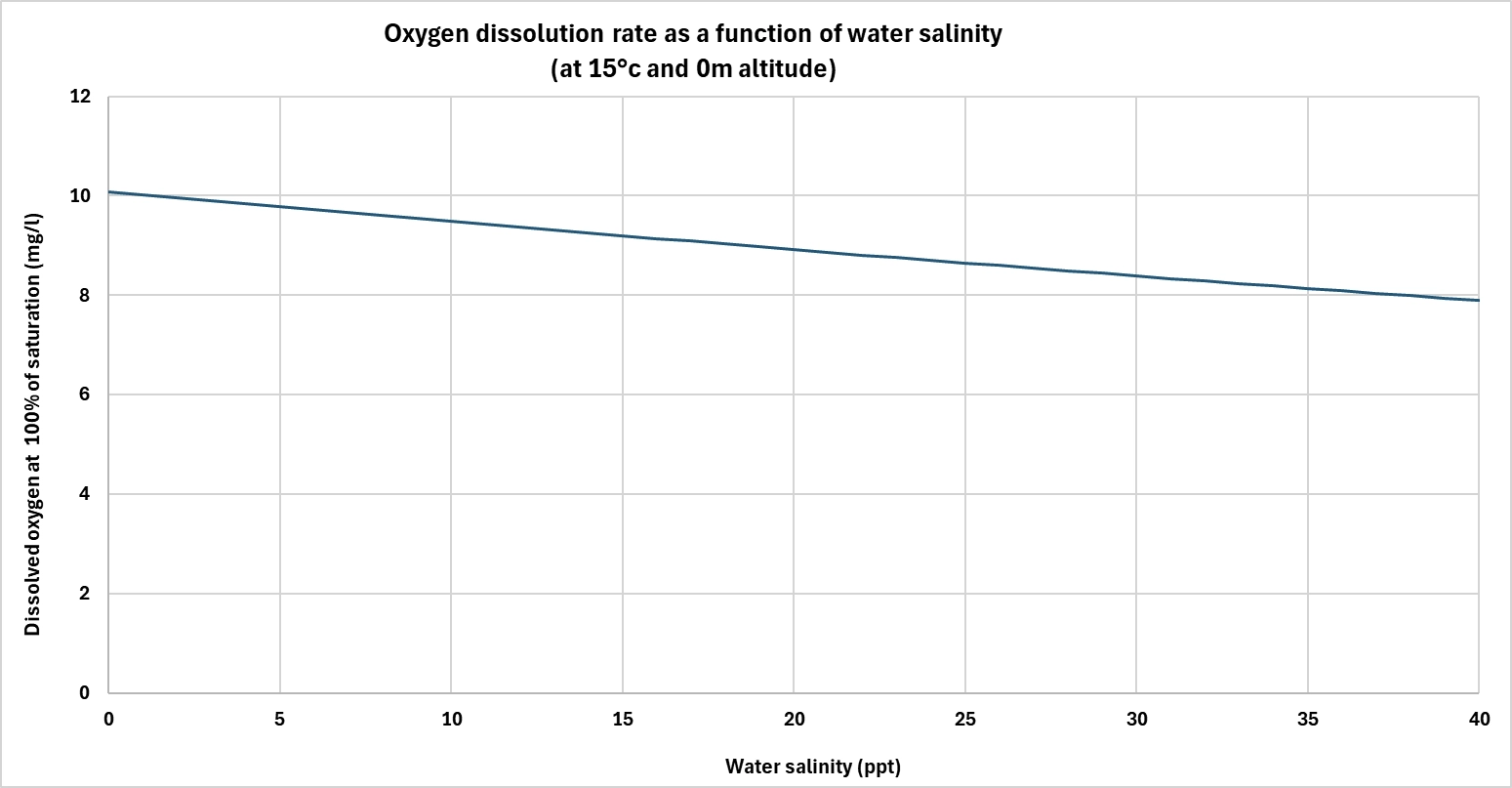
Anche la salinità gioca un ruolo importante. Più l'acqua è salata, meno ossigeno disciolto può contenere.
I sali disciolti prendono il posto delle molecole di gas, riducendo la capacità complessiva dell'acqua di immagazzinare ossigeno. Pertanto, a temperatura e pressione costanti, l'acqua di mare contiene naturalmente meno ossigeno disciolto rispetto all'acqua dolce.
Questo fattore è particolarmente importante nel trattamento di acque salmastre o salate, nell'industria o nelle zone costiere, dove le strategie di ossigenazione devono essere adattate alle specifiche condizioni fisico-chimiche.
Pressione e altitudine
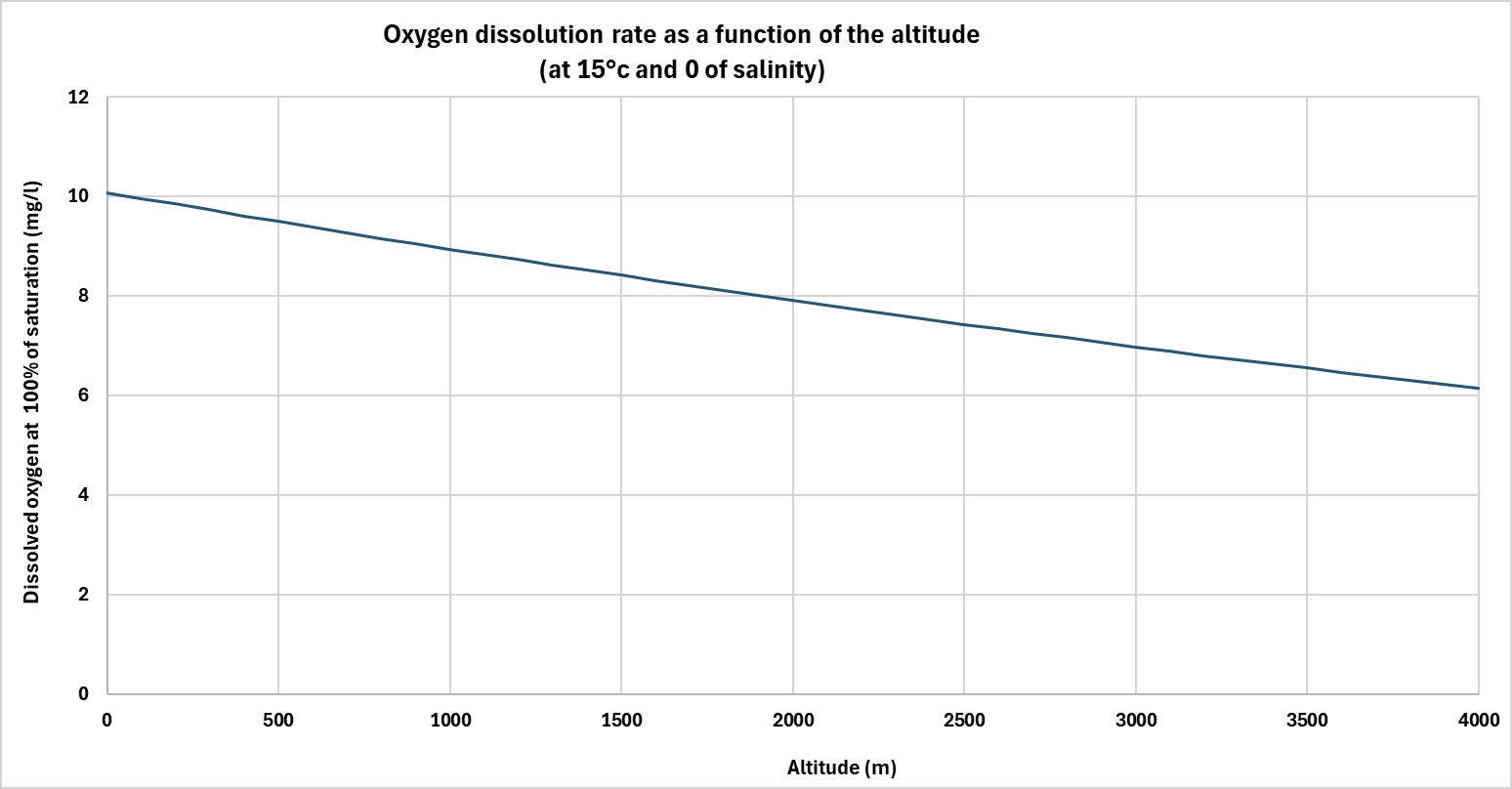
La pressione atmosferica influisce direttamente sulla solubilità dei gas in acqua, compreso l'ossigeno. Più alta è la pressione, più ossigeno l'acqua può sciogliere.
In altitudine, la pressione atmosferica diminuisce, riducendo la capacità di saturazione dell'ossigeno. Al contrario, in un ambiente pressurizzato, la solubilità aumenta. Questo principio viene sfruttato in diverse tecnologie di trattamento delle acque, in particolare per ottenere acqua sovrasatura di ossigeno.
Ad esempio, i coni di ossigeno funzionano generalmente a una pressione di diversi bar. Questa sovrapressione consente di raggiungere livelli di concentrazione molto più elevati rispetto alla pressione atmosferica. Una volta rilasciata la pressione, l'acqua rimane temporaneamente in uno stato di supersaturazione, che può migliorare l'efficacia dei trattamenti (ossidazione in acquacoltura, prevenzione dell'H₂S, filtro biologico, ....).
Conclusioni
La saturazione dell'ossigeno disciolto è determinata da noti fattori fisici: temperatura, salinità e pressione. La loro influenza è fondamentale in tutti i settori legati all'acqua, come l'acquacoltura e il trattamento delle acque reflue.
Che si tratti di garantire il corretto funzionamento di un impianto di trattamento delle acque reflue, di massimizzare il rendimento di un processo di ossidazione, di limitare gli odori molesti nelle reti di acque reflue o di preservare un equilibrio ecologico, il controllo di questi parametri è una leva essenziale per un'ossigenazione efficiente e adeguata.

