L’oxygène dissous (OD) est un élément clé dans de nombreux systèmes liés à l’eau : stations d’épuration, procédés biologiques, aquaculture, etc…. La concentration maximale d’oxygène que l’eau peut contenir, appelée taux de saturation, dépend de plusieurs facteurs physico-chimiques. Comprendre l’influence de ces paramètres est essentiel pour concevoir, optimiser ou piloter des systèmes où l’oxygénation joue un rôle crucial.
Température
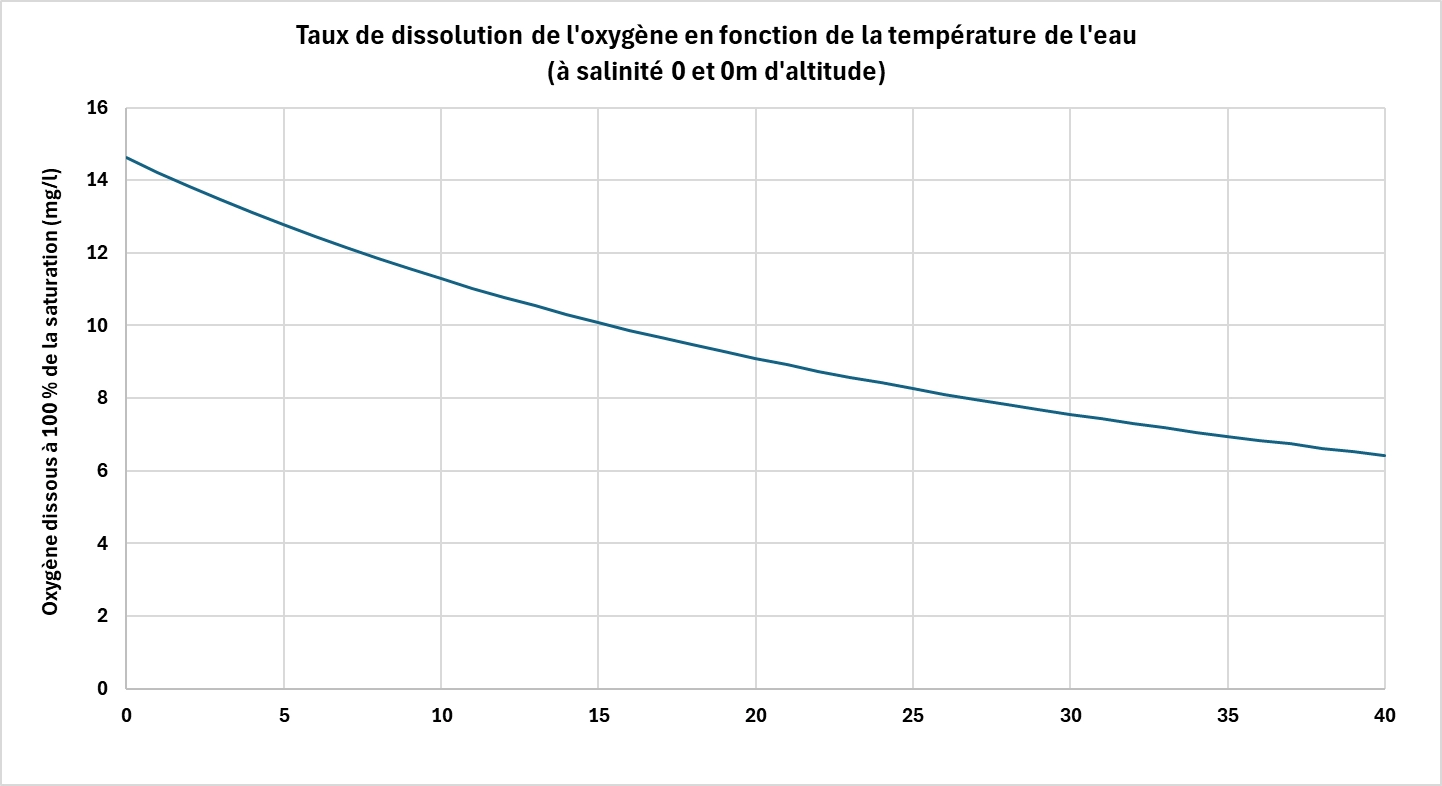
La température de l’eau est l’un des paramètres les plus influents sur la solubilité de l’oxygène. Plus l’eau est chaude, moins elle peut dissoudre d’oxygène.
Ce phénomène s’explique par l’agitation thermique des molécules : en augmentant, la température réduit les interactions entre les molécules d’eau et les molécules d’oxygène, facilitant leur libération dans l’atmosphère. À titre d’exemple, à pression atmosphérique normale, l’eau douce peut contenir environ 14,6 mg/L d’oxygène à 0 °C, contre seulement 7,6 mg/L à 30 °C.
Dans les procédés biologiques, cette diminution de la solubilité peut poser problème, car les besoins en oxygène augmentent souvent avec la température (ex : activité bactérienne en station d’épuration ou RAS), tandis que la disponibilité de l’oxygène diminue. Il devient alors nécessaire de compenser cette baisse par une meilleure diffusion ou un apport en oxygène pur.
Salinité
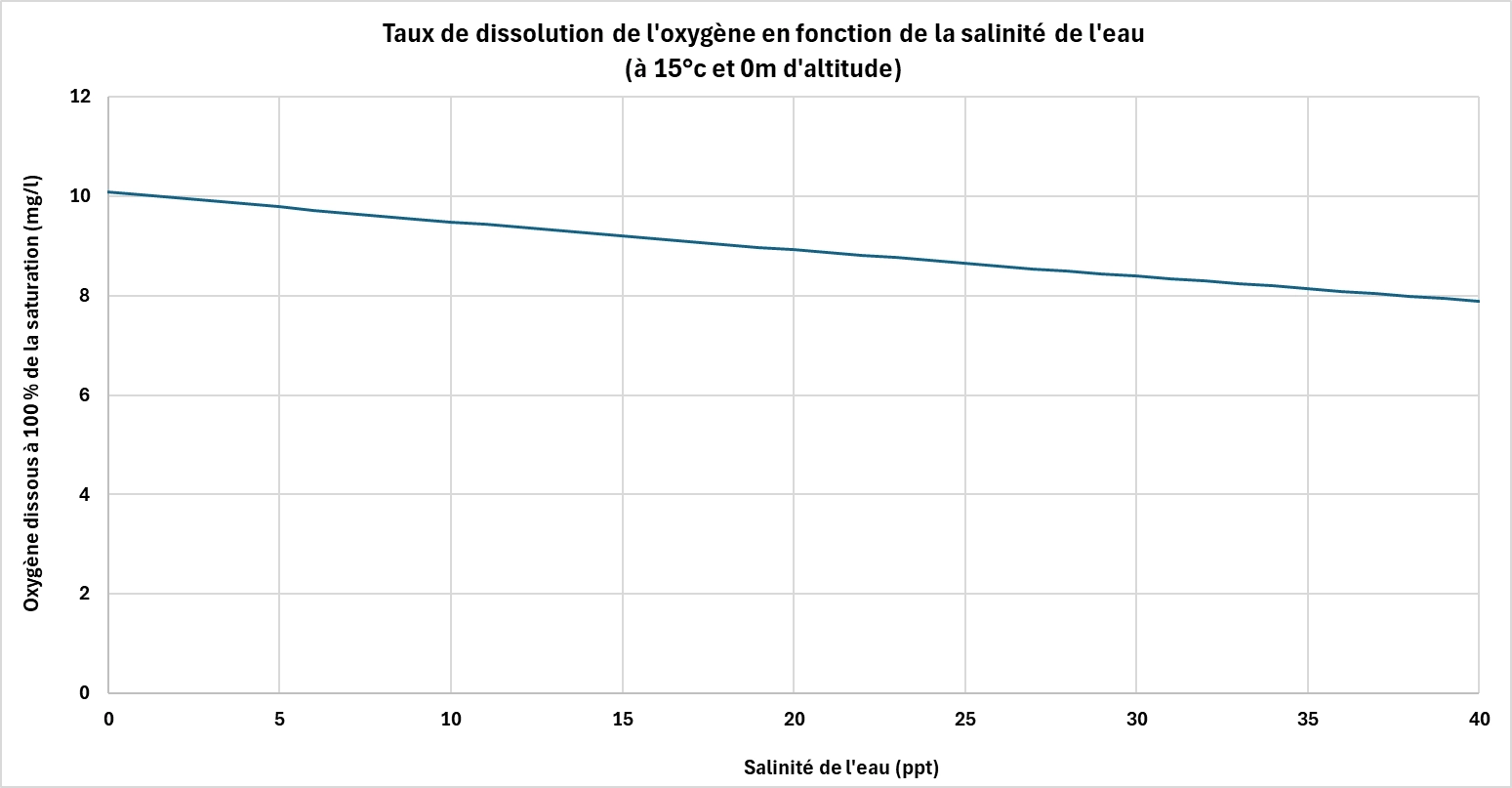
La salinité joue également un rôle important. Plus l’eau est salée, moins elle peut contenir d’oxygène dissous.
Les sels dissous prennent la place des molécules de gaz, réduisant la capacité globale de l’eau à stocker de l’oxygène. Ainsi, à température et pression constantes, l’eau de mer contient naturellement moins d’oxygène dissous que l’eau douce.
Ce facteur est particulièrement important pour le traitement d’eaux saumâtres ou salées, dans l’industrie ou dans les zones côtières, où les stratégies d’oxygénation doivent être adaptées aux conditions physico-chimiques spécifiques.
Pression et altitude

La pression atmosphérique conditionne directement la solubilité des gaz dans l’eau, dont celle de l’oxygène. Plus la pression est élevée, plus l’eau peut dissoudre d’oxygène.
En altitude, la pression atmosphérique baisse, ce qui diminue la capacité de saturation en oxygène. À l’inverse, dans un environnement pressurisé, la solubilité augmente. Ce principe est exploité dans plusieurs technologies de traitement de l’eau, notamment pour obtenir de l’eau sursaturée en oxygène.
Par exemple, les cônes à oxygène opérèrent généralement à une pression de l’ordre plusieurs bars. Cette surpression permet d’atteindre des niveaux de concentration bien supérieurs à ceux possibles à pression atmosphérique. Une fois la pression relâchée, l’eau reste temporairement en état de sursaturation, ce qui peut améliorer l’efficacité des traitements (oxydation en aquaculture, prévention du H₂S, filtre biologique,….).
Conclusion
Le taux de saturation en oxygène dissous est déterminé par des facteurs physiques bien connus : la température, la salinité et la pression. Leur influence est cruciale dans tous les domaines li és à l’eau comme l’aquaculture et le traitement des eaux usées.
Que ce soit pour garantir le bon fonctionnement d’une station d’épuration, maximiser les rendements d’un procédé d’oxydation, limiter les nuisances odorantes dans les réseaux d’eaux usées, ou encore pour préserver un équilibre écologique, la maîtrise de ces paramètres est un levier essentiel pour une oxygénation efficace et adaptée.

